
Hemofilia B
El diagnóstico preciso de la hemofilia B (HB) depende de pruebas de coagulación, que se realizan conforme a protocolos y procedimientos rigurosos, y que requieren conocimientos específicos y habilidades, así como también el aseguramiento de la calidad.1
Los estudios de la coagulación, incluida la evaluación del tiempo de protrombina (PT) o del tiempo de tromboplastina parcial activada (aPTT), se realizan a cualquier paciente con presunto trastorno de la coagulación.1 Si el PT es normal, se excluyen las deficiencias de las vías de coagulación extrínseca y común. Un aPTT prolongado en presencia de un PT normal sugiere una deficiencia de la vía de coagulación intrínseca o común, o la presencia de un inhibidor de factor de la coagulación.
Se requieren estudios de corrección para diferenciar si un aPTT prolongado es producto de la deficiencia de un factor o de anticoagulantes, incluido un inhibidor de factor de la coagulación.1 Si el aPTT se normaliza con la presencia del complemento completo de los factores de la coagulación del plasma normal en el estudio de corrección, es más probable que se trate de una deficiencia de factor más que de la presencia de un inhibidor. Se realizan pruebas de actividad de un factor para ofrecer un diagnóstico diferencial del factor de la coagulación deficitario.1
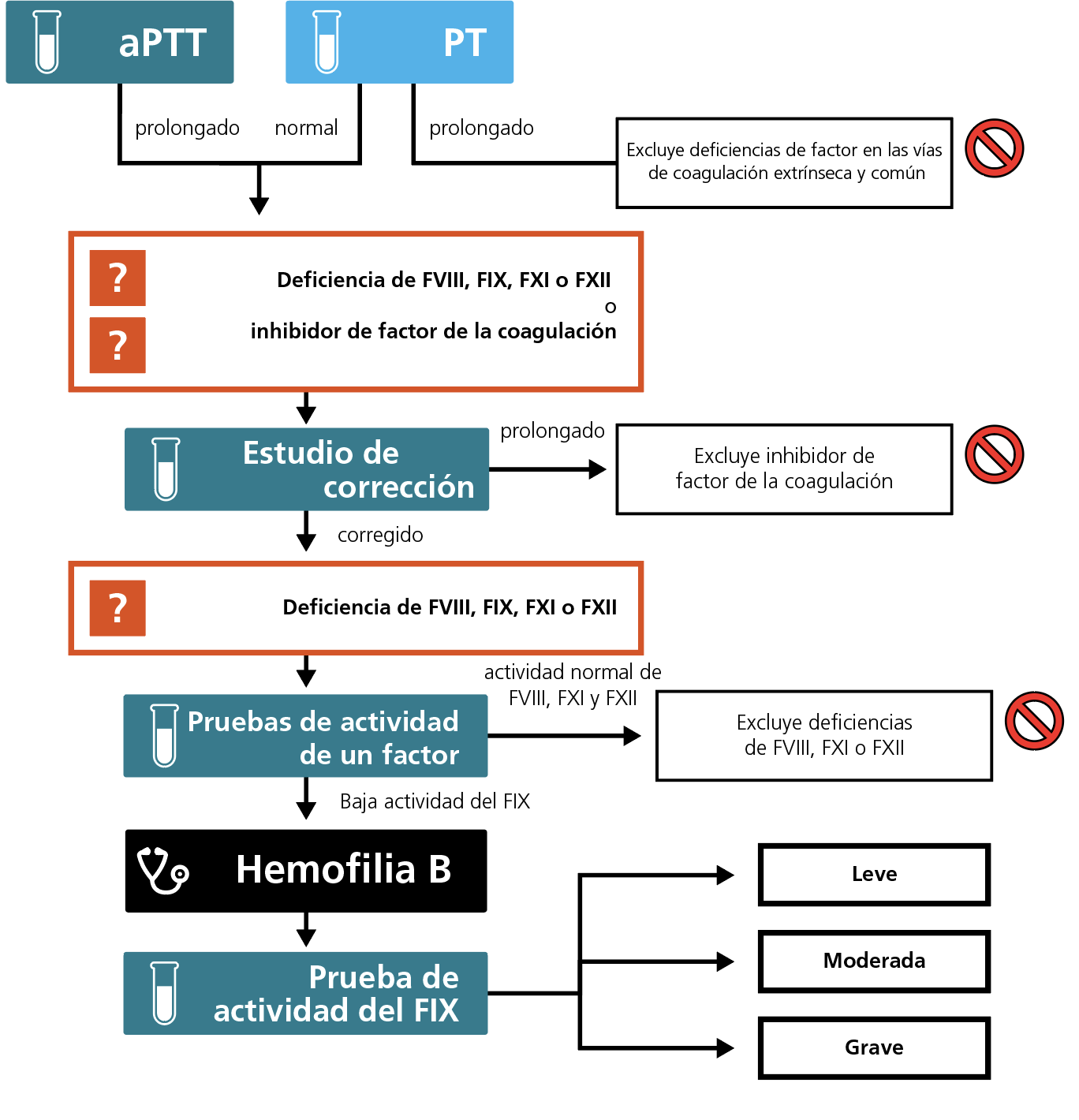
Algoritmo para el diagnóstico en laboratorio de la hemofilia B.
Tiempo de tromboplastina parcial activada (aPTT)2,3
El aPTT mide la funcionalidad de las vías de la cascada de coagulación intrínseca (o de activación por contacto) y común.2 El tiempo de coagulación medido se compara con el de las muestras de plasma de control a fin de determinar si existe un retraso en la coagulación. El tiempo de formación del coágulo es proporcional al grado de deficiencia del factor o inhibición.
Los valores normales del aPTT dependen del laboratorio en particular y de los reactivos utilizados, pero suelen oscilar entre 22 y 40 segundos..2 Los resultados entre laboratorios pueden variar según el método del laboratorio, los instrumentos y reactivos utilizados.2,4
Los resultados de las pruebas de evaluación del PT y del aPTT pueden interpretarse juntos para identificar y excluir algunos trastornos. Un PT normal excluye deficiencias en las vías de coagulación extrínseca y común. Un aPTT prolongado en presencia de un PT normal indica una deficiencia en la vía de la coagulación intrínseca (es decir, FVIII, FIX, FXI o FXII), enfermedad de von Willebrand grave, la presencia de un anticoagulante lúpico o inhibidores de factor.
Estudios de corrección
Los estudios de corrección se utilizan para distinguir entre deficiencias de un factor y la presencia de un inhibidor. El plasma de prueba se mezcla 1:1 con plasma normal (con 100% de niveles normales de FIX) y se incuba a 37 oC durante 1 a 2 horas. Un aPTT normalizado indica una deficiencia de un factor de la coagulación. Un aPTT prolongado indica la presencia de un inhibidor.
Pruebas de coagulación basada en el aPTT de una etapa
La prueba de coagulación basada en el aPTT de una etapa deriva del aPTT y se realiza para cuantificar la actividad del FIX para clasificar la gravedad de la enfermedad o monitorear el tratamiento.5,6 El plasma de prueba se mezcla con un plasma con deficiencia de un factor específico (que contiene niveles normales de todos los factores de la coagulación, pero es deficitario en el factor de interés), y se supone que el factor deficitario en el plasma de prueba es determinante de la velocidad del tiempo de coagulación.
Es posible que la detección de la actividad reducida del FIX en pacientes con HB leve se vea limitada en las pruebas de coagulación de una etapa, incluso si se utiliza el reactivo más sensible para la prueba.7,8 Por consiguiente, es necesario realizar una prueba cromogénica de actividad del factor si los resultados de la prueba de coagulación de una etapa muestran una actividad normal del factor en pacientes con síntomas hemorrágicos.
Pruebas cromogénicas de actividad del factor
La prueba cromogénica de dos etapas también puede utilizarse para medir la actividad del FIX para clasificar la gravedad de la enfermedad o monitorear el tratamiento.6,9 En el primer paso, el plasma de prueba se mezcla con cofactores, fosfolípidos, calcio, protrombina o trombina y FX. La cantidad de FXa producida es proporcional al nivel de FIX presente. En el segundo paso, se añade un sustrato cromogénico específico para FXa y se cuantifica la concentración de FXa monitoreando fotométricamente el sustrato escindido.
En la actualidad, las pruebas cromogénicas de actividad del FIX cuentan con la marca CE en Europa, pero solo están disponibles para investigación (RUO) en EE. UU.
Pautas internacionales
La Federación Mundial de Hemofilia (WFH) recomienda la realización de la prueba de coagulación de una etapa para el diagnóstico de la HB.10
Monitoreo del tratamiento
El monitoreo del factor de coagulación durante el tratamiento incluye la evaluación de los niveles de actividad del factor pre y posinfusión. Si la recuperación es más lenta de lo previsto, es posible que el paciente haya desarrollado un inhibidor del FIX. El Consejo Asesor Médico y Científico (MASAC) de la Fundación Nacional de Hemofilia recomienda las pruebas cromogénicas del FIX para el monitoreo del tratamiento, cuando estas pruebas estén aprobadas por la Administración de Alimentos y Medicamentos (FDA) de EE. UU.11
El uso de la farmacocinética clínica para la optimización de la terapia está bien establecido en pacientes con hemofilia.12
Monitoreo durante cirugía
Los pacientes con HB reciben tratamiento y se monitorean los niveles de actividad del factor durante el período perioperatorio para asegurarse de que la actividad del factor es suficiente para evitar una hemorragia o resangrado descontrolado.
- World Federation of Hemophilia (WFH): Guidelines for the Management of Hemophilia; 2012.
- Bates SM, Weitz JI. Coagulation assays. Circulation 2005;112:e53-60.
- Langdell RD, Wagner RH, Brinkhous KM. Effect of antihemophilic factor on one-stage clotting tests; a presumptive test for hemophilia and a simple one-stage antihemophilic factor assy procedure. J Lab Clin Med 1953;41:637-47.
- Kitchen S, Kershaw G, Tiefenbacher S. Recombinant to modified factor VIII and factor IX - chromogenic and one-stage assays issues. Haemophilia 2016;22 Suppl 5:72-7.
- Ingerslev I. Laboratory assays in hemophilia. In: Textbook of Hemophilia. Chichester, UK: Blackwell Publishing Ltd; 2010.
- Kitchen S, Preston E. Assay of factor VIII and other clotting factors In: Kitchen S, Olson J, Preston E, eds. Quality in Laboratory Hemostasis and Thrombosis: Wiley-Blackwell; 2013.
- Park CH, Seo JY, Kim HJ, Jang JH, Kim SH. A diagnostic challenge: mild hemophilia B with normal activated partial thromboplastin time. Blood Coagul Fibrinolysis 2010;21:368-71.
- Pouplard C, Trossaert M, A LEQ, Delahousse B, Giraudeau B, Gruel Y. Influence of source of phospholipids for APTT-based factor IX assays and potential consequences for the diagnosis of mild haemophilia B. Haemophilia 2009;15:365-8.
- Wilmot HV, Hogwood J, Gray E. Recombinant factor IX: discrepancies between one-stage clotting and chromogenic assays. Haemophilia 2014;20:891-7.
- Kitchen S, McCraw A, Echenagucia M. Diagnosis of hemophilia and other bleeding disorders. A laboratory manual. Montreal, Canada: World Federation of Hemophilia; 2010.
- MASAC statement regarding use of various clotting factor assays to monitor factor replacement therapy. National Hemophilia Foundation MASAC Document #228 2014: http://www.hemophilia.org/sites/default/files/document/files/masac-228.pdf last accessed March 16, 2015.
- Bjorkman S, Berntorp E. Pharmacokinetics of coagulation factors: clinical relevance for patients with haemophilia. Clin Pharmacokinet 2001;40:815-32.
