
Deficiencia congénita del factor VII
Se puede sospechar de un trastorno hemorrágico congénito con base en una diatesis hemorrágica clínica desde temprana edad en pacientes con una deficiencia congénita del factor (F)VII (FVII CD) grave. Es posible que en los individuos con un fenotipo hemorrágico más leve el trastorno se identifique por casualidad en el contexto de procedimientos invasivos o lesiones traumáticas y hemorragias inexplicables o anormales. Ambas situaciones deben dar lugar a una investigación inicial mediante pruebas de detección en laboratorio.1,2
Un tiempo de protrombina prolongado aislado (PT) y un tiempo de tromboplastina parcial activado normal (TTPa) proporcionan los primeros datos de laboratorio para el diagnóstico de la FVII CD, ya que esto afecta solo a la vía de coagulación extrínseca. No obstante, los reactivos del PT tienen una sensibilidad variable y las formas más leves de FVII CD pueden pasar desapercibidas. Esta sospecha puede confirmarse con la prueba de la actividad del FVII y el análisis molecular para determinar la mutación causante.1,2
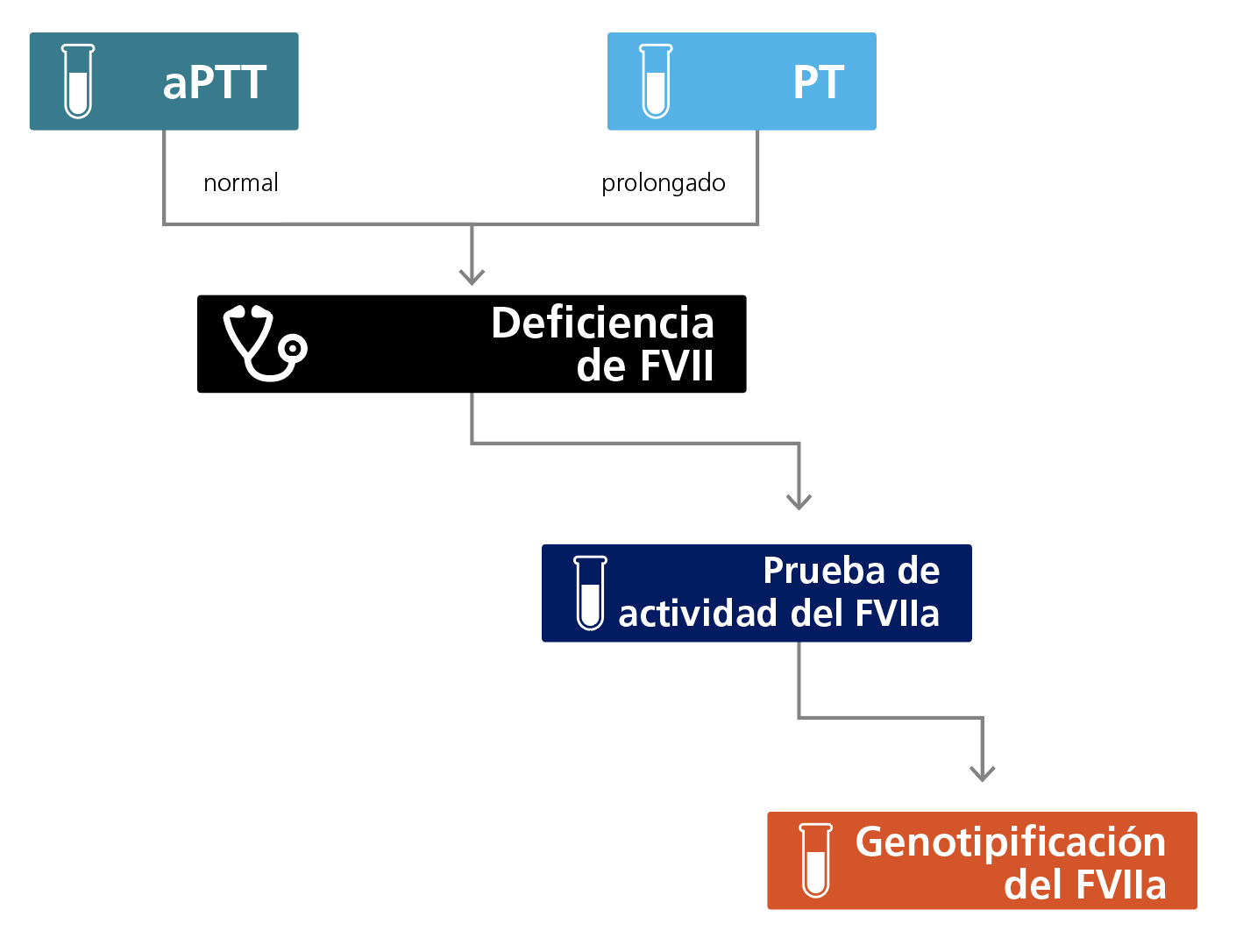
Algoritmo para el diagnóstico en laboratorio de la deficiencia del FVII.
Primeras pruebas de detección en laboratorio
Los resultados de las pruebas de detección del PT y del aPTT pueden interpretarse juntos para identificar y excluir algunos trastornos de la coagulación. Si el PT es normal, se excluyen las deficiencias de las vías de coagulación extrínseca y común (es decir., FV, FVIII, FIX, FX, FXI or FXII). Un PT prolongado aislado sugiere inmediatamente una deficiencia del FVII. La prolongación del índice normalizado internacional (INR) puede depender del nivel de FVII en el plasma. Además de las lesiones genéticas, puede haber otros factores que influencien el nivel de actividad del FVII como la enfermedad hepática, una deficiencia de vitamina K o un tratamiento con antagonistas de la vitamina K.1,2 No todos los reactivos detectan todos los defectos moleculares del FVII, es por ello que el PT puede ser normal con un reactivo pero anormal con otro. En este caso, los resultados obtenidos con reactivos con factor tisular (TF) humano tienen más probabilidades de correlacionarse con el panorama clínico.
Pruebas de actividad de un factor
El FVII activado (FVIIa) está presente en el plasma con una concentración de 5–15 ng/mL en individuos normales, lo que representa alrededor de 1–3% del pool total de FVII, con una vida media de 2 a 3 horas. Las pruebas de actividad del FVII sirven para confirmar la falta de actividad del FVII/FVIIa. Una prueba coagulométrica utiliza un TF soluble truncado (TFF) recombinante que no puede activar el zimógeno FVII y, por lo tanto, mide la actividad del FVIIa en una muestra dada. La misma prueba también puede utilizarse para medir la generación de trombina o la actividad del FXa usando sustratos fluorogénicos. Una prueba fluorogénica separada, que también utiliza un sustrato fluorogénico basado en el FXa, activa el FVII a FVIIa y luego mide la actividad total. Así, se pueden esclarecer entonces las proporciones relativas del FVII activado y zimógeno juntas.2,3
La elección de los reactivos para las pruebas para medir la actividad del FVII en base a la prueba de coagulación es fundamental ya que el origen de la tromboplastina utilizada en la prueba puede afectar los resultados. Además, las cantidades residuales de actividad del FVII en un plasma deficitario en factor pueden reducir la sensibilidad de las pruebas en el rango de baja actividad. La calibración de la prueba con un estándar de plasma y la introducción de TF recombinante y preparaciones de fosfolípidos sintéticos han reducido la variabilidad entre laboratorios relacionada con estos componentes.1-3
Análisis molecular (genotipificación)
El análisis genético molecular del gen del FVII (F7) representa la norma de oro para confirmar un diagnóstico de FVII CD. En la mayoría de los casos, una secuencia de F7 completa luego de una amplificación por PCR convencional identifica la lesión genética. El análisis también resulta útil en presencia de un fenotipo hemorrágico o actividad del FVII discordante o un patrón de herencia confuso. También es posible realizar un diagnóstico prenatal mediante la sangre del cordón umbilical en presencia de antecedentes familiares o hemorragias.1
Pruebas inmunológicas de antígenos del FVII
Las deficiencias basadas en la activación del zimógeno se pueden confirmar o excluir con un ensayo inmunoenzimático (ELISA) para el FVII disponible a fin de distinguir entre el zimógeno FVII y el FVIIa.
- Lapecorella M, Mariani G, International Registry on Congenital Factor FVII Deficiency. Factor VII deficiency: defining the clinical picture and optimizing therapeutic options. Haemophilia 2008;14:1170-5.
- Mariani G, Bernardi F. Factor VII deficiency. Semin Thromb Hemost 2009;35:400-6.
- Amiral J, Dunois C, Amiral C, Seghatchian J. The various assays for measuring activity states of factor VIIa in plasma and therapeutic products: Diagnostic value and analytical usefulness in various pathophysiological states. Transfus Apher Sci 2017;56:91-7.
- de Moerloose P, Schved JF, Nugent D. Rare coagulation disorders: fibrinogen, factor VII and factor XIII. Haemophilia 2016;22 Suppl 5:61-5.
